

单元测试卷丨学科知识同步丨期中期末卷等
点击领取>>>2014-2019北京中考真题、北京各区一模、二模试题及答案解析汇总
北京四中 高一年级先进学期化学期中诊断。化学诊断之前应该怎样复习呢?首先不能乱了阵脚,认真复习课本内容,包括课本的实验、方程式以及基本概念,抓好基础才能稳步提高。抽时间做去年的期中诊断试题作为考前模拟适应性训练,检验自己的知识掌握水平。下面,小编为大家带来北京四中 高一年级先进学期化学期中诊断的相关内容,供大家参考。
北京四中 高一年级先进学期化学期中诊断


点击了解>>>学而思爱智康中考冲刺精品课程 咨询课程请拨打:![]()
考点1:吸热反应与放热反应
1、吸热反应与放热反应的区别
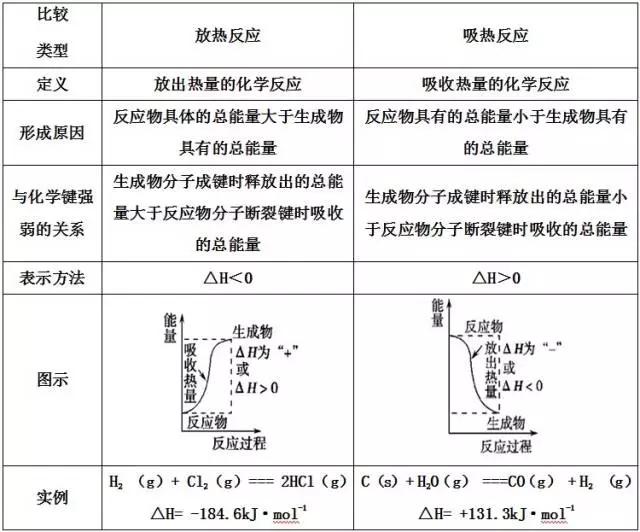
特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应
①一切燃烧反应;
②活泼金属与酸或水的反应;
③酸碱中和反应;
④铝热反应;
⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应
①Ba(OH)2·8H2O与NH4Cl反应;
②大多数分解反应是吸热反应
③等也是吸热反应;
④水解反应
考点2:北京四中 高一年级先进学期化学期中诊断 反应热的依据
1.根据热化学方程式
反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量
ΔH=E生成物-E反应物。
3.根据键能
ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:
①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学。
5.根据物质燃烧放热数值:Q(放)=n(可燃物)×|ΔH|。
获取完整版方法:
1.点击链接:https://jinshuju.net/f/1Ki3F0 领取2014-2019北京中考真题、北京各区一模、二模试题及答案解析汇总,填写姓名、电话信息后即可跳转百度云盘地址,免费获取。
这一期的北京四中 高一年级先进学期化学期中诊断小编就介绍到这里,“书山有路勤为径,学海无涯苦作舟”,学习没有捷径可走,唯有“勤奋”。想了解相关课程的同学,请拨打学而思爱智康免费咨询电话:![]()
小编推荐:北京四中考上清华大学
小编推荐:北京数学中功课2018