

单元测试卷丨学科知识同步丨期中期末卷等
2019年高考化学反应热、燃烧热、中和热!高中化学还算是很好学习的,热学部分还是比较好学的部分,距离高考还有一个月左右的时间,我们再来复习较后一次知识点吧!下面是2019年高考化学反应热、燃烧热、中和热!!同学们冲刺高考,加油!
想要了解2019年北京高诊断卷的相关资料,请点击加入【爱智康高中交流福利群】 ,并直接向管理员“小康康”索取!爱智康高中交流福利群会不定期免费发放学习资料,高中以及高考政策等相关消息,请持题目,续关注!
,并直接向管理员“小康康”索取!爱智康高中交流福利群会不定期免费发放学习资料,高中以及高考政策等相关消息,请持题目,续关注!
2019年高考化学反应热、燃烧热、中和热(一)

2019年高考化学反应热、燃烧热、中和热(二)
1. 化学反应中能量变化的原因及主要表现形式。
(1)化学反应通常都伴随着能量的变化:
化学反应中,由于反应物转变为生成物的过程中,经历了旧化学键断裂和新化学键形成的过程,破坏旧键需要吸收能量;而形成新键则要释放能量,因此,化学反应通常都伴随着能量的变化。
(2)化学反应发生能量变化的原因:
化学反应中有新物质生成,而生成物具有的总能量与反应物具有的总能量不同,这就是化学反应发生能量变化的原因。
(3)化学反应中能量变化的主要表现形式:
化学能与热能之间的转化。
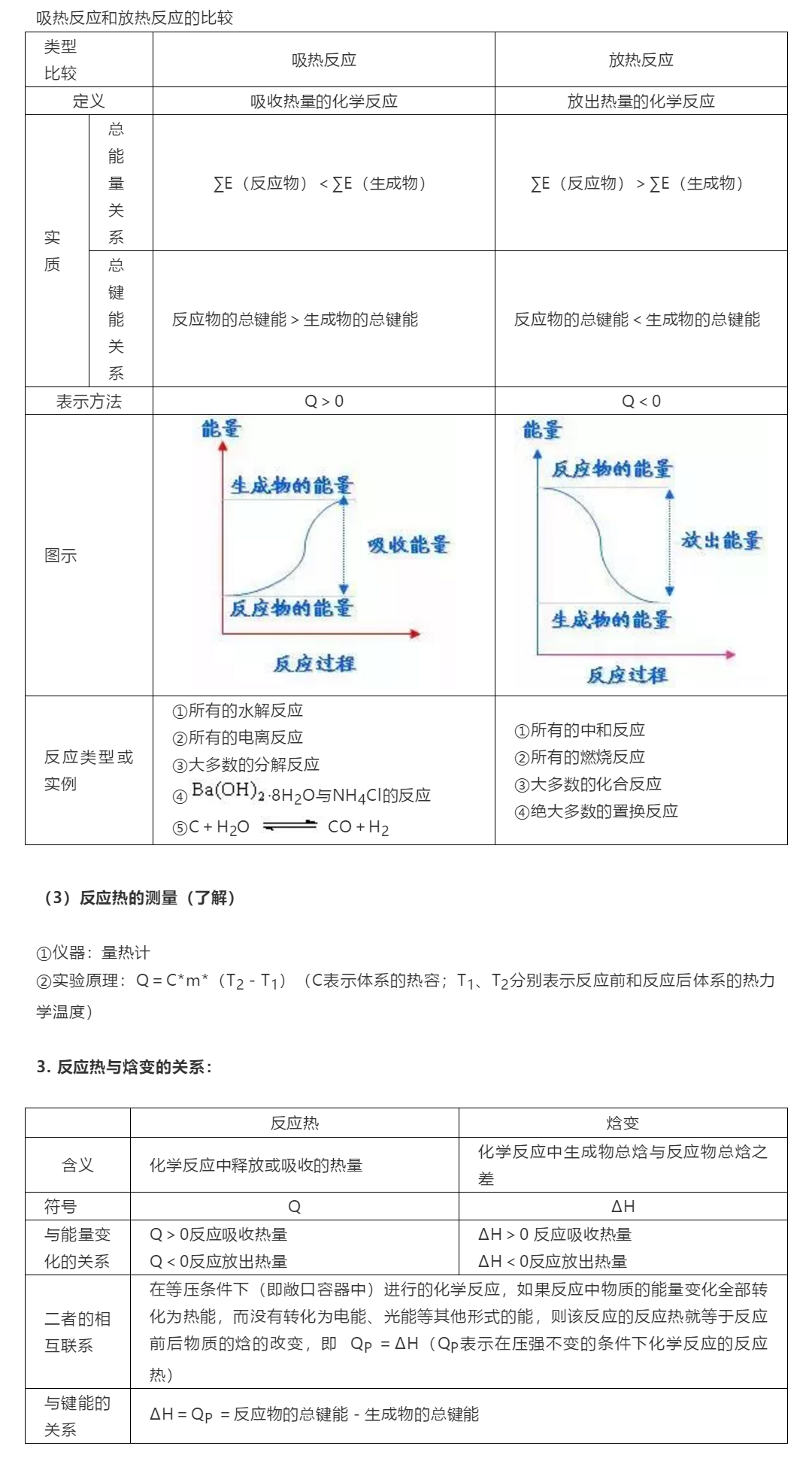
2. 反应热及热效应的分类:
(1)反应热的分类:
根据反应类型和研究对象的不同,反应热可分为生成热、分解热、中和热、燃烧热、溶解热等。
①中和热:在稀溶液中,酸与碱发生中和反应生成1mol H2O时所放出的热量。
②燃烧热:是指在25℃、101kPa下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
(2)热效应的分类:分为吸热反应和放热反应。
2019年高考化学反应热、燃烧热、中和热(三)
例1、下列与化学反应的能量变化相关的叙述,正确的是
A. 生成物的总能量一定低于反应物的总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的不同
解析:生成物总能量低于反应物总能量的反应,是放热反应,若是吸热反应则情况相反,故A错;反应速率与反应是吸热还是放热没有必然的联系,故B错;C是盖斯定律的重要应用,正确;根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,故D错。
答案:C
例2、下列判断正确的是
A. 测定硫酸铜晶体中结晶水的含量时,灼烧至固体发黑,测定值小于理论值
B. 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C. 0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D. 1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L 1mol·L-1硫化钠溶液吸收SO2的量
解析:测定硫酸铜晶体中结晶水的含量时,灼烧至固体发黑,说明部分硫酸铜分解生成了氧化铜,释放出的SO2被成了结晶水,故测定值大于理论值,A错;氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1mol H2的能量,B错;碳酸的酸性弱于醋酸,故此相同浓度的碳酸钠溶液的pH大于醋酸钠溶液的pH,C对;1L 1mol·的溶液中含有溶质1mol,前者发生:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑;后者发生:2Na2S+5SO2+2H2O=4NaHSO3+3S↓;分析可知,很明显后者大于前者,D错。
答案:C
例3、据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:
2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),则下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 由反应需在300℃下进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
解析:催化剂能提高化学反应速率,加快反应进行,缩短反应时间,也就是提高了生产效率,但不能提高生产率,A对;反应需在300℃下进行是为了获得较快的反应速率,但不能说明该反应是吸热还是放热,B错;充入大量CO2气体,能使平衡正向移动,提高H2的转化率,C对;从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,D对。
答案:B
例4、下列说法正确的是
A. 废旧电池应集中回收,并填埋处理
B. 充电电池放电时,电能转变为化学能
C. 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D. 所有燃烧反应都是放热反应,所以不需吸收能量就可进行
解析:A项废旧电池应集中回收但不能填埋处理,因为电池里的重金属会污染土壤,人吃了种在这些土壤里的蔬菜后会引发疾病;B项,充电电池放电时,化学能转变为电能;D项,有的燃烧反应需要吸收一定的热量方可进行,比如碳的燃烧。
答案:C
例5、在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436kJ的能量,断裂1mol Cl-Cl键要吸收243kJ的能量,断裂1mol H—Cl键要吸收432kJ的能量,则在氯气中充分燃烧1mol H2 的能量变化是 。
解析:在氯气中充分燃烧1mol H2 时,要先破坏1mol的H—H键和1mol的Cl—Cl键,此过程是需要吸收679kJ能量的;在氯气中充分燃烧1mol H2 时会形成2mol H—Cl键,放出864kJ的能量,吸收和放出的能量相抵后,仍会放出185kJ的能量。
答案:放出185kJ能量
相关推荐:2019年高考化学物质的组成、性质和分类
爱智康高中教育频道为大家分享的2019年高考化学反应热、燃烧热、中和热!到这里就结束啦,有关北京高考考前辅导及考后规划的课程,请直接拨打免费咨询电话: !2019年高考距离大家越来越近,同学们一定要把握现在,有困难克服一下,拿个好成绩。
!2019年高考距离大家越来越近,同学们一定要把握现在,有困难克服一下,拿个好成绩。