

单元测试卷丨学科知识同步丨期中期末卷等
高一化学期末考复习知识点:化学平衡的移动,由智康网高中频道精心整理,欢迎老师同学们进行高中学习准备使用。如果对你有帮助,请继续支持智康网高中频道,并提出您的宝贵建议,小编会尽较大的努力给大家收集较好较实用的高考复习准备信息!
1、概念
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,不发生平衡移动。
(3)v正<v逆:平衡向逆反应方向移动。
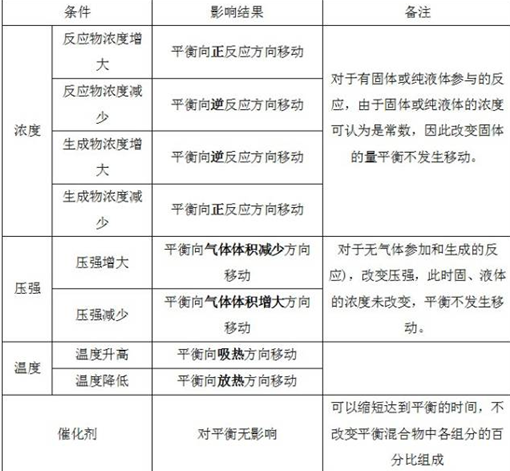
3、影响化学平衡的因素
4、“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小
5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
【】 为大家介绍好了,如果同学们在高中学习中还有什么问题的话,请直接拨打智康网高中频道免费咨询电话:4000-121-121,会有专业的高中权威老师为您解答!