

单元测试卷丨学科知识同步丨期中期末卷等
高中化学是实验性比较强的学科,同学们需要记忆大量的化学方程式、实验现象、化学特征等,有些内容十分相似,难以区分,因此同学们更要科学记忆这些知识点。化学实验室高考的重难点,为了帮助同学们学好高中化学实验部分,爱智康高考频道小编为同学们整理了北京高中化学探究性实验题目,希望给同学们带来一定的帮助。
北京高中化学探究性实验题目(一)
朝阳一模28.(15分)某孩子对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是 (2)调节PH,实验记录如下:

查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液 ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 ②推测a中白色沉淀为Ag2SO4,推测的依据是
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。 (4)将中滤出、洗净,为确认其组成,实验如下: Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据上述现象,分析X的性质和元素组成是 ③Ⅱ中反应的化学方程式是
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下:
①气体Y是 。
②白色沉淀转化为X的化学方程式是
北京高中化学探究性实验题目(二)
东城一模28.(15分)某孩子欲通过实验方法验证Fe2+的性质。 (1)该同学在实验前,依据Fe2+的 性,填写了下表。
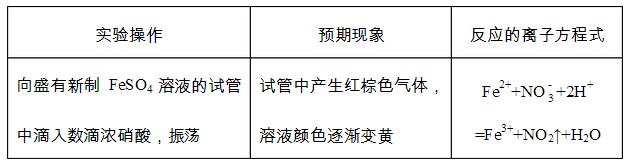
依照表中操作,该同学进行实验。观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验。
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红。
该现象的结论是 。
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用,如图装置(气密性已检验,尾气处理装置略)进行探究。

ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同。
①铜与足量浓硝酸反应的化学方程式是 ; ②装置乙的作用是 ; ③步骤ⅱ的目的是 ; ④该实验可得出的结论是 。
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 。
北京高中化学探究性实验题目就为同学们分享到这里了,如果大家还有什么问题的话,请直接拨打免费咨询电话:4000-121-121!有专业的老师为您解答!