酸碱盐是中考化学的必考点,近几期唯唯会帮大家梳理这部分的基础知识点,可以结合自己所学复习下哦~
酸碱盐基础知识点梳理
第一部分 常见的酸
1. 定义:在水溶液中解离时产生的阳离子全部是氢离子(或H+)的化合物
2. 常见酸的特性及用途
(1)盐酸
① 浓盐酸具有挥发性,敞口放置时瓶口形成白雾,有刺激性气味;纯净的浓盐酸是无色的液体
② 用途:用于金属除锈、电镀、化工生产等。人体胃液中含有盐酸,可帮助消化
(2)硫酸
① 不易挥发,无味;纯净的浓硫酸是无色、黏稠的油状液体
② 浓硫酸的特性:
吸水性:实验室中常用来作气体干燥剂
脱水性:可使蔗糖、纸张等脱水而炭化
腐蚀性:如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠(或NaHCO3)溶液
③ 用途:用于金属除锈、生产车用电池、化肥、农药、精炼石油等
3. 化学通性(酸5条)
酸具有通性的原因是:在水溶液中都能解离出H+(或氢离子)
(1)与酸碱指示剂反应:能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
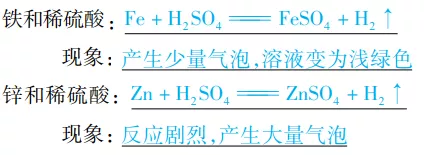
(2)与活泼金属反应:
通式:酸+活泼金属→盐+H2↑(置换反应)
举例:
(3)与某些金属氧化物反应
通式:酸+金属氧化物→盐+H2O(复分解反应)
举例:

(4)与碱反应
通式:酸+碱→盐+H2O(复分解反应)
举例:
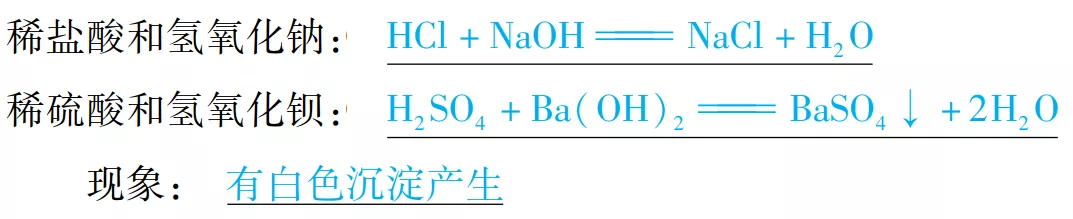
(5)与某些盐反应
通式:酸+盐→新酸+新盐(酸+碳酸盐→新盐+H2O+CO2↑)(复分解反应)
举例:
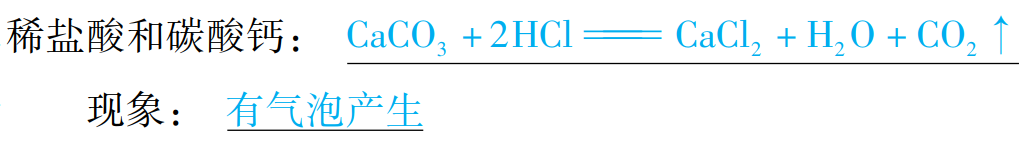
【注意】不同酸具有“个性”的原因是:含有的酸根离子(或阴离子)不同。
如:
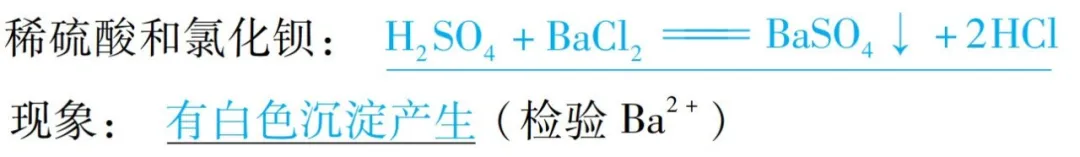
练一练
1. 为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题:
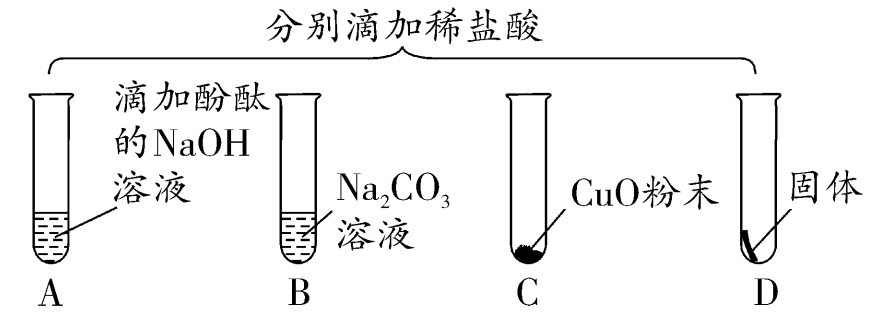
(1)写出能证明A中反应发生的现象_________。
(2)写出上述实验中酸与金属氧化物反应的化学方程式___________________________。
(3)要全面验证酸的化学通性,D试管中能与酸反应的固体单质是____(写一种即可)。
(4)实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有___种(溶质不计指示剂与气体)。
2. 某班同学为验证酸的化学通性,做了五组实验。分析并回答问题。
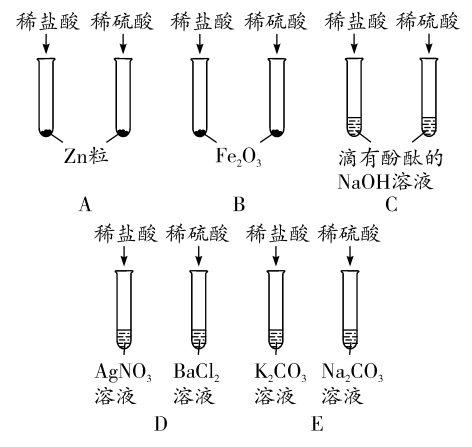
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是_____。
(2)B组试管中实验现象相同,该现象是________________。
(3)写出C组任一试管中发生反应的化学方程式:____________________。
(4)上述五组实验中没有体现酸的通性的是_____(填序号)。
答案:
1. (1)红色消失(或红色褪去)
(2)CuO+2HCl═CuCl2+H2O
(3)镁(或铝、锌、铁等,写化学式也可)
(4)四(或4)
2. (1)盐酸具有挥发性(或盐酸会挥发出氯化氢气体或制得的氢气中混有氯化氢气体)
(2)红棕色固体逐渐减少,溶液变成黄色
(3)NaOH+HCl═NaCl+H2O
(或2NaOH+H2SO4═Na2SO4+2H2O)
(4)D












